10x Multiome ATAC+GEX产品提供了一种综合的、可伸缩的多组学方法,用于检测同一单个细胞核中的转录组信息和染色质可及性信息。与独立的Chromium Next GEM单细胞ATACv1.1和Chromium Next GEM单细胞基因表达v3.1分析相比,这种多组学方法提供了一种可同时获取同一个单细胞的基因组开放数据和转录组表达水平数据的技术,从而使研究人员可以将不同生物事件中的各种单细胞的基因组染色质开放信息与基因表达程度进行准确关联,以便更好地在细胞和分子水平上对发育遗传学、神经科学、免疫组学、肿瘤和其它疾病机理等关键生命科学领域开展深入研究。
EcDNA 中心驱动协同分子间癌基因表达
EcDNA hubs drive cooperative intermolecular oncogene expression
期刊:Nature 发表时间:2021.11.24 发表单位:斯坦福大学 影响因子:49.962
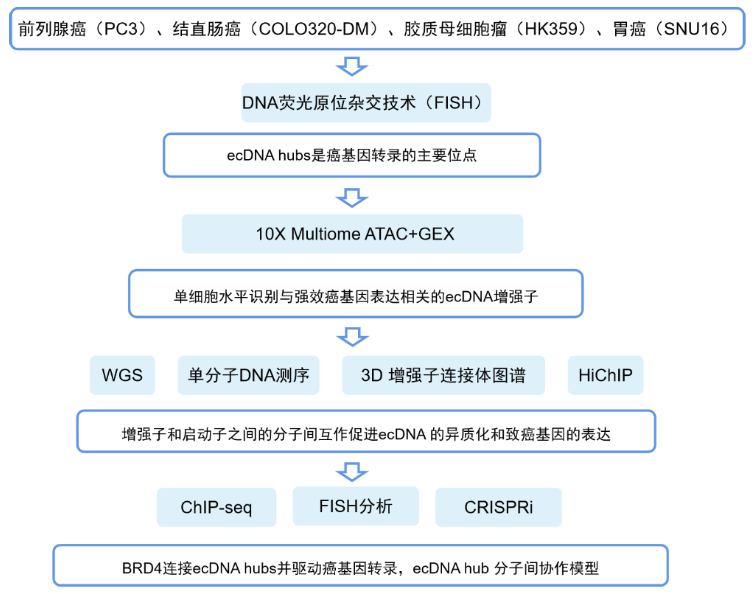
染色体外DNA(ecDNA)在人类癌细胞中普遍存在,编码癌基因的ecDNA是癌症基因组的普遍特征,其可以通过基因扩增和改变基因调控来介导癌基因的高表达。因为缺乏着丝粒,故ecDNA在细胞分裂过程中被随机分隔到子细胞,这一特性使ecDNA在肿瘤耐药性方面发挥作用。但目前对于ecDNA在细胞核中的空间组织和其在细胞分裂期间或DNA损伤时聚集的生物学后果尚不清楚。
ecDNA hubs是癌基因转录的主要位点
研究人员利用DNA荧光原位杂交(FISH)技术,分别可视化了前列腺癌(PC3)、结直肠癌(COLO320-DM)、胶质母细胞瘤(HK359)以及胃癌(SNU16)细胞间期的ecDNA在细胞核中的定位,发现其呈现明显的聚集性,并将其称为ecDNA hubs。随后联合DNA和新生RNA FISH,发现ecDNA hubs上致癌基因的转录活性明显高于染色体位点,表明ecDNA hubs是癌基因转录的主要位点。
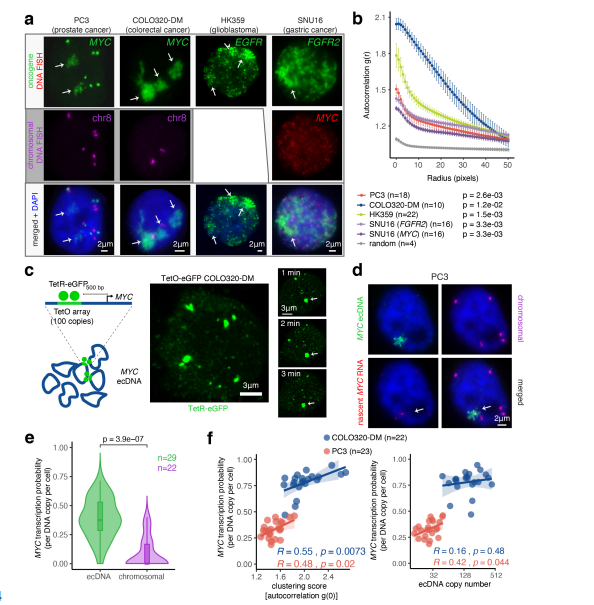
图1 ecDNA成像显示ecDNA聚类和协同转录爆发
10X Multiome ATAC+GEX助力单细胞水平识别与强效癌基因表达相关的ecDNA增强子
为了了解ecDNA上致癌基因表达的调控,研究人员通过10X Multiome ATAC+GEX技术在单细胞水平上鉴定了与癌基因高表达相关的ecDNA上的调控元件并检测了癌细胞的异质性,以及ecDNA与癌基因转录的关系。结果发现MYC的开放性随RNA表达而增加,高MYC表达的COLO320-DM细胞既包含更高的ecDNA拷贝数,也包含更多的调控元件,表明细胞间增强子的差异可能是ecDNA 癌基因表达异质性的关键。
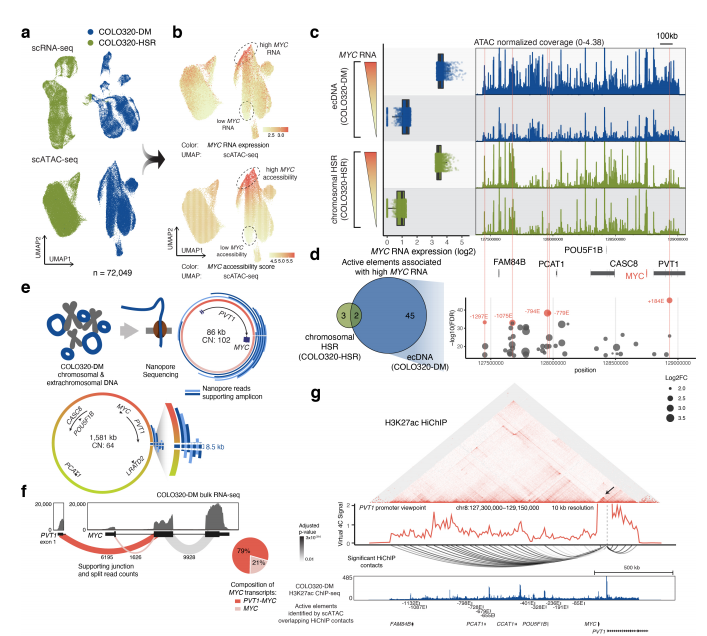
图2 基因组解剖鉴定与高 MYC 表达、ecDNA 序列异质性和增强子-启动子接触相关的 ecDNA 增强子
BRD4连接ecDNA hubs并驱动癌基因转录
研究人员通过整合WGS、单分子DNA测序和3D 增强子连接体图谱,分析ecDNA hubs对致癌基因表达的调控。结果表明增强子和启动子之间的互作促进ecDNA的异质化和致癌基因的表达。通过ChIP-seq结果和ATAC-seq数据,表明H3K27ac 存在时激活的ecDNA增强子,与BRD4同时存在,BRD4连接ecDNA hubs,促进致癌基因的转录,ecDNA hubs的形成依赖于BET蛋白,而ecDNA hubs的破坏会引起MYC致癌基因转录的抑制和ecDNA癌细胞的死亡,表明ecDNA可能是调控致癌基因表达的有力途径。
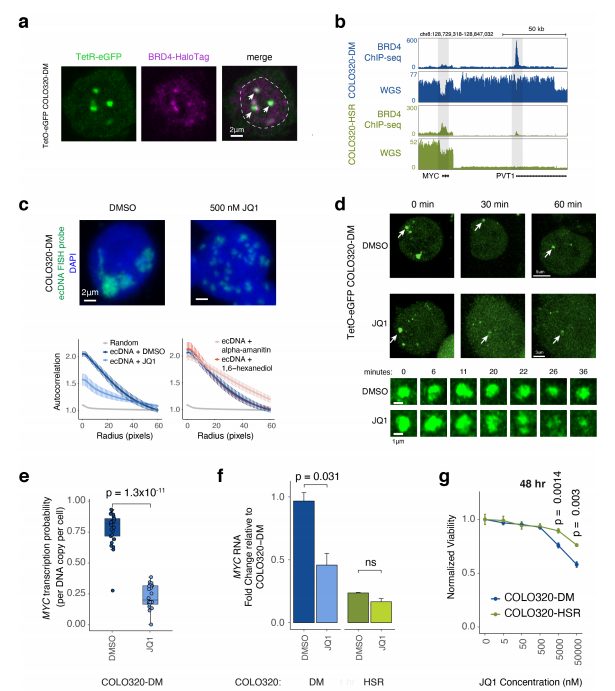
图3 BET蛋白介导ecDNA枢纽的形成和转录
EcDNA hubs调控两个癌基因位点的分子互作
最后,研究人员通过CRISPRi靶向候选调控元件,发现MYC和FGFR2启动子的CRISPR干扰会显著降低相应的基因表达。FGFR2启动子的基因敲除对MYC表达无影响,表明FGFR2蛋白下调不影响MYC表达。MYC蛋白可能作为FGFR2的转录激活因子。最后通过DNA FISH和体外CRISPR干扰验证了FGFR2反式增强子在98–100%的ecDNA分子上未与MYC基因共价连接,表明分子间增强子元件是直接修饰反式中的基因表达,而不是通过下游效应。
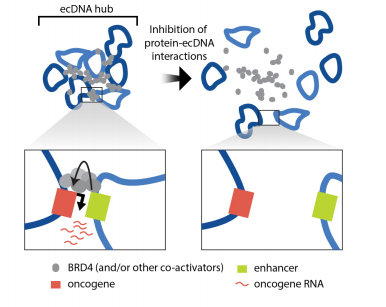
图4 ecDNA hub 分子间协作模型
ecDNA的局部聚集促进了新的分子间增强子-基因相互作用和癌基因过表达。ecDNA hubs可能还涉及不同ecDNA分子上的转录调控元件,这些转录调控元件也可能调控远距离的基因表达,研究还发现与蛋白质相连的ecDNAhubs能够实现分子间转录调控,并可以作为致癌基因功能和协同进化的单位,为癌症治疗提供新的潜在途径。
Hung KL, Yost KE, Xie L, Shi Q, Helmsauer K, Luebeck J, Schöpflin R, Lange JT, Chamorro González R, Weiser NE, Chen C, Valieva ME, Wong IT, Wu S, Dehkordi SR, Duffy CV, Kraft K, Tang J, Belk JA, Rose JC, Corces MR, Granja JM, Li R, Rajkumar U, Friedlein J, Bagchi A, Satpathy AT, Tjian R, Mundlos S, Bafna V, Henssen AG, Mischel PS, Liu Z, Chang HY. ecDNA hubs drive cooperative intermolecular oncogene expression[J]. Nature. 2021 Dec;600(7890):731-736.